 |
Os Alunos Fernando Henrique e Sidny Antonio ( OBS.: O Aluno Eduardo Henrique Substituiu Sidny Antonio Devido Problemas ) e Apresentaram a Experiencia:
Serpente de Faraó
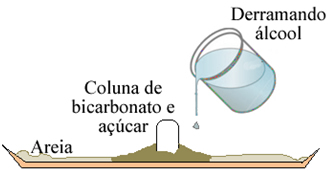
O experimento da Serpente de Faraó pode ser feito por meio da queima de uma mistura de bicarbonato de sódio e açúcar.
Versão original da serpente de Faraó, em que se queima tiocianato de mercúrio, mas é uma experiência muito perigosa*
“Serpente de Faraó” é o nome dado a uma experiência clássica de Química em que se queima o tiocianato de mercúrio (Hg(SCN)2). A partir de uma pequena amostra, começam a crescer estruturas semelhantes a uma cobra de cinzas. No entanto, essa é uma experiência que não pode ser realizada em sala de aula, pois libera vapores bastante perigosos.
Mas existe uma alternativa de experimento que tem um efeito visual um pouco menor que esse, mas que também é interessante e pode ser utilizado em sala de aula ao se estudar o conteúdo de “Combustão”. Veja como é fácil:
“Serpente de Faraó” é o nome dado a uma experiência clássica de Química em que se queima o tiocianato de mercúrio (Hg(SCN)2). A partir de uma pequena amostra, começam a crescer estruturas semelhantes a uma cobra de cinzas. No entanto, essa é uma experiência que não pode ser realizada em sala de aula, pois libera vapores bastante perigosos.
Mas existe uma alternativa de experimento que tem um efeito visual um pouco menor que esse, mas que também é interessante e pode ser utilizado em sala de aula ao se estudar o conteúdo de “Combustão”. Veja como é fácil:
Materiais e reagentes:
- Almofariz e pistilo (ou um pilão com socador, igual ao que os cozinheiros usam para amassar alho);
- Uma seringa;
- Bicarbonato de sódio;
- Açúcar;
- Álcool;
- Algum recipiente com graduação para medir o volume do álcool;
- Colher;
- Fósforos;
- Recipiente com areia;
- Pinça metálica.

- Almofariz e pistilo (ou um pilão com socador, igual ao que os cozinheiros usam para amassar alho);
- Uma seringa;
- Bicarbonato de sódio;
- Açúcar;
- Álcool;
- Algum recipiente com graduação para medir o volume do álcool;
- Colher;
- Fósforos;
- Recipiente com areia;
- Pinça metálica.

Procedimento Experimental:
1. Coloque no almofariz uma parte de bicarbonato para duas de açúcar, triture bem com o pistilo, formando um pó bem fininho e misture-os;
 2- Adicione algumas gotinhas de álcool para que a mistura dê liga;
3- Corte a parte da seringa onde se coloca a agulha e coloque dentro dela essa mistura, a fim de formar uma espécie de coluna. Quanto maior você fizer, maior será o resultado do experimento. Depois, empurre com o êmbolo para que a coluna saia da seringa e deposite-se sobre a areia;
4- Derrame cerca de 20 mL de álcool ao redor dessa coluna;
5- Com muito cuidado, coloque fogo no sistema. Você observará que à medida que queima, a coluna vai ficando preta e vai crescendo. Com a ajuda da pinça e com muito cuidado para não se queimar, vá guiando a “serpente” para que ela cresca no sentido que desejar.
2- Adicione algumas gotinhas de álcool para que a mistura dê liga;
3- Corte a parte da seringa onde se coloca a agulha e coloque dentro dela essa mistura, a fim de formar uma espécie de coluna. Quanto maior você fizer, maior será o resultado do experimento. Depois, empurre com o êmbolo para que a coluna saia da seringa e deposite-se sobre a areia;
4- Derrame cerca de 20 mL de álcool ao redor dessa coluna;
5- Com muito cuidado, coloque fogo no sistema. Você observará que à medida que queima, a coluna vai ficando preta e vai crescendo. Com a ajuda da pinça e com muito cuidado para não se queimar, vá guiando a “serpente” para que ela cresca no sentido que desejar.
1. Coloque no almofariz uma parte de bicarbonato para duas de açúcar, triture bem com o pistilo, formando um pó bem fininho e misture-os;

2- Adicione algumas gotinhas de álcool para que a mistura dê liga;
3- Corte a parte da seringa onde se coloca a agulha e coloque dentro dela essa mistura, a fim de formar uma espécie de coluna. Quanto maior você fizer, maior será o resultado do experimento. Depois, empurre com o êmbolo para que a coluna saia da seringa e deposite-se sobre a areia;
4- Derrame cerca de 20 mL de álcool ao redor dessa coluna;
5- Com muito cuidado, coloque fogo no sistema. Você observará que à medida que queima, a coluna vai ficando preta e vai crescendo. Com a ajuda da pinça e com muito cuidado para não se queimar, vá guiando a “serpente” para que ela cresca no sentido que desejar.
Resultado e Discussão:
O açúcar comum é a sacarose (C12H22O11) e o bicarbonato de sódio é o sal hidrogenocarbonato de sódio ou carbonato ácido de sódio (NaHCO3).
Quando a sacarose queima, ocorre a sua combustão completa e, assim como ocorre com todos os compostos formados por carbono, hidrogênio e oxigênio, os produtos liberados são dióxido de carbono e água:
C12H22O11(s) + 12 O2 (g) → 12 CO2(g) + 11 H2O(l)
Ocorre também a decomposição térmica do bicarbonato:
2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Na2CO3(s) → Na2O(s) + CO2(g)
Além disso, nesse processo também ocorre a combustão incompleta da sacarose, em que um dos produtos é o carbono, constituinte do carvão. É por isso que se forma a estrutura de cor preta. O gás carbônico liberado tanto na combustão completa da sacarose quanto na decomposição do bicarbonato faz a estrutura de carbono inflar, crescendo, e é isso que dá o efeito de uma serpente subindo.
Algum Tempo Depois.
O açúcar comum é a sacarose (C12H22O11) e o bicarbonato de sódio é o sal hidrogenocarbonato de sódio ou carbonato ácido de sódio (NaHCO3).
Quando a sacarose queima, ocorre a sua combustão completa e, assim como ocorre com todos os compostos formados por carbono, hidrogênio e oxigênio, os produtos liberados são dióxido de carbono e água:
C12H22O11(s) + 12 O2 (g) → 12 CO2(g) + 11 H2O(l)
Ocorre também a decomposição térmica do bicarbonato:
2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Na2CO3(s) → Na2O(s) + CO2(g)
Além disso, nesse processo também ocorre a combustão incompleta da sacarose, em que um dos produtos é o carbono, constituinte do carvão. É por isso que se forma a estrutura de cor preta. O gás carbônico liberado tanto na combustão completa da sacarose quanto na decomposição do bicarbonato faz a estrutura de carbono inflar, crescendo, e é isso que dá o efeito de uma serpente subindo.
As Alunas Andressa Rodrigues e Chaihanne Apresentaram a Experiencia:
A água que muda de cor
MATERIAL UTILIZADO
· Água
· Soda Cáustica (NaOH)
· Bicarbonato de Sódio (NaHCO3)
· Vinagre de álcool
· Extrato de repolho roxo (indicador de pH)
· Três béqueres ou copos de vidro
· Colher
· Peneira ou funil e filtro de papel
· Água
· Soda Cáustica (NaOH)
· Bicarbonato de Sódio (NaHCO3)
· Vinagre de álcool
· Extrato de repolho roxo (indicador de pH)
· Três béqueres ou copos de vidro
· Colher
· Peneira ou funil e filtro de papel
PROCEDIMENTO
Ø Preparação do extrato de repolho roxo:
· Corte o repolho roxo em pedaços pequenos, acrescente água e leve ao fogo até que o líquido fique com um roxo intenso e coe com uma peneira ou passe pelo filtro de papel. Ou,
· Corte o repolho roxo em pedaços pequenos, bata no liquidificador e coe com uma peneira ou funil e filtro de papel.
Ø Preparação do experimento:
· Coloque água no primeiro copo e, usando luvas e óculos de proteção, adicione uma pequena quantidade de soda cáustica, mexa bem e reserve. Lembre-se que a soda cáustica é corrosiva e tóxica, então o copo e a colher, usados não devem ser reaproveitados, deverão ir para o lixo em seguida e daí a importância de se usar as luvas e os óculos de segurança.
· No segundo copo, coloque água e um pouco de bicarbonato de sódio, mexa bem e reserve.
· No terceiro copo coloque o vinagre de álcool e reserve.
· Pronto, já temos três copos com líquidos totalmente transparentes, semelhantes à água.
Agora, adicione o extrato de repolho roxo em cada um dos copos e observe:
v Obs.: O líquido verde muda para amarelo à medida que a soda cáustica vai reagindo com o repolho roxo.
O QUE ACONTECEU?
· Você verificou que os líquidos ficaram cada um com uma cor característica. Mas porque isso aconteceu? Fácil... Cada copo continha uma mistura com pH diferentes. Mas o que isso significa?
Ø Vamos começar falando do que é o pH?
· O pH é um índice que indica a alcalinidade , a neutralidade ou a acidez de um meio. Onde o “p” é o potencial de concentração e o “H” se refere ao íon hidrogênio (H+), ou seja, o pH mostra a concentração de H+no meio. Então:
· Soluções ácidas: pH < 7
· Soluções neutras: pH = 7
· Soluções alcalinas: pH > 7
Ø Para que servem os indicadores de pH?
· Os indicadores são substâncias que tem a propriedade de mudar de cor em intervalos pequenos de pH. O extrato de repolho roxo é um dos mais populares indicadores naturais de pH, mas temos também o extrato de beterraba, de uva, de jabuticaba, de amora, dentre outros. Eles substituem muito bem os papéis indicadores universais que só podem ser adquiridos em lojas especializadas.
Ø Escala de pH de algumas substâncias:
Escala de cores para diferentes pHs, obtida do repolho roxo.

25/09/2014
Ø Preparação do extrato de repolho roxo:
· Corte o repolho roxo em pedaços pequenos, acrescente água e leve ao fogo até que o líquido fique com um roxo intenso e coe com uma peneira ou passe pelo filtro de papel. Ou,
· Corte o repolho roxo em pedaços pequenos, bata no liquidificador e coe com uma peneira ou funil e filtro de papel.
Ø Preparação do experimento:
· Coloque água no primeiro copo e, usando luvas e óculos de proteção, adicione uma pequena quantidade de soda cáustica, mexa bem e reserve. Lembre-se que a soda cáustica é corrosiva e tóxica, então o copo e a colher, usados não devem ser reaproveitados, deverão ir para o lixo em seguida e daí a importância de se usar as luvas e os óculos de segurança.
· No segundo copo, coloque água e um pouco de bicarbonato de sódio, mexa bem e reserve.
· No terceiro copo coloque o vinagre de álcool e reserve.
· Pronto, já temos três copos com líquidos totalmente transparentes, semelhantes à água.
Agora, adicione o extrato de repolho roxo em cada um dos copos e observe:
v Obs.: O líquido verde muda para amarelo à medida que a soda cáustica vai reagindo com o repolho roxo.
O QUE ACONTECEU?
· Você verificou que os líquidos ficaram cada um com uma cor característica. Mas porque isso aconteceu? Fácil... Cada copo continha uma mistura com pH diferentes. Mas o que isso significa?
Ø Vamos começar falando do que é o pH?
· O pH é um índice que indica a alcalinidade , a neutralidade ou a acidez de um meio. Onde o “p” é o potencial de concentração e o “H” se refere ao íon hidrogênio (H+), ou seja, o pH mostra a concentração de H+no meio. Então:
· Soluções ácidas: pH < 7
· Soluções neutras: pH = 7
· Soluções alcalinas: pH > 7
Ø Para que servem os indicadores de pH?
· Os indicadores são substâncias que tem a propriedade de mudar de cor em intervalos pequenos de pH. O extrato de repolho roxo é um dos mais populares indicadores naturais de pH, mas temos também o extrato de beterraba, de uva, de jabuticaba, de amora, dentre outros. Eles substituem muito bem os papéis indicadores universais que só podem ser adquiridos em lojas especializadas.
Ø Escala de pH de algumas substâncias:
Escala de cores para diferentes pHs, obtida do repolho roxo.
 |
25/09/2014
Os Alunos Eduardo, Washington e Kaisson Apresentaram a Experiencia:
Densidade dos Líquidos
A densidade determina a quantidade de matéria que está presente em uma unidade de volume. De forma prática, o experimento elucida a teoria de maneira a fazer os alunos se questionarem porque um liquido flutua sobre o outro mostrando que a mesma quantidade de volume de diferentes líquidos podem possuir diferentes pesos.
Introdução
No nosso cotidiano são inúmeros os acontecimentos que desconhecemos suas causas, são situações simples, que passam despercebidas ou que não apresentamos interesse em desvendá-las.
Material
Para facilitar a realização do experimento e permitir que o aluno o reproduza em sua residência é preferível utilizar materiais de fácil acesso a todos, como produtos que podemos encontrar em nossas casas.Caso sejam utilizados materiais de laboratório, deve-se citar algum que seja proporcional a este. EX. Béquer = copo de vidro, medidas de volume = xícaras, etc.
um copo alto de vidro
uma medida de óleo de cozinha ou azeite
uma medida de água
uma medida de álcool etílicouma colher de tinta guache
A medida a ser utilizada dos líquidos deve ser a mesma, podendo ser estipulada em ml ou xícaras, por exemplo.
Montagem
- Derramar a água colorida no copo do experimento;
- Com o copo levemente inclinado adicionar o óleo, derramando-o pela lateral do copo;
- Ainda com o copo inclinado adicionar o álcool da mesma forma, derramando-o pela lateral do copo;
- Deixar o copo em repouso sobre a bancada;
- Observar o comportamento dos líquidos.
Hipóteses
Posso mudar a ordem de inclusão dos líquidos?
Teremos o mesmo resultado?
Elementos Para Testar as Hipóteses
Caso haja material suficiente, permita que o grupo repita a experiência colocando os líquidos no copo na ordem que desejarem.
Observações
Independentemente da ordem pela qual os líquidos sejam colocados no recipiente, eles vão sempre ocupar a mesma posição de acordo com a sua densidade.
Recolhendo um volume igual para cada um dos líquidos analisados, o volume recolhido de líquido mais denso seria o que apresentava maior quantidade de matéria (massa), sendo por isso o mais pesado.
Resultados
Os alunos perceberão que os líquidos não se misturam e um se sobrepõe ao outro, formando camadas facilmente visualizadas devidos a coloração diferenciada dos líquidos.
Discussão de Conteúdo
O ocorrido deve-se a diferente densidade dos líquidos, onde o álcool é o líquido com menor densidade permanecendo no topo das camadas, a água é o líquido mais denso entre os três permanecendo no fundo do copo e o óleo com densidade intermediaria à densidade do álcool e da água, permanecendo entre estas duas camadas.
Dicas
Este conteúdo integra o tema Densidade dos Materiais, sejam eles sólidos, líquidos ou gasosos. Cabe ao professor adequar a realização deste experimento dentro de seu planeamento de aula de forma a não negligenciar os demais conteúdos a serem abordados dentro do tema citado.
Noções Científicas
Densidade dos Líquidos, Volume e Massa.
um copo alto de vidro
uma medida de óleo de cozinha ou azeite
uma medida de água
uma medida de álcool etílicouma colher de tinta guache
Posso mudar a ordem de inclusão dos líquidos?
Resultados
Dicas
Noções Científicas
Densidade dos Líquidos, Volume e Massa.
O Aluno Thalisson Lukas Apresentou a Experiencia:
Cores Primarias e Secundadrias
Cores Primárias
As cores primárias são: vermelho amarelo e azul. São consideradas as primeiras cores. O vermelho é uma cor quente que mostra vitalidade energia e coragem. O amarelo é uma cor suave e alegre que simboliza o otimismo. O azul é a cor que dá concentração e melhora a mente.
Cores secundárias
As cores secundárias são formadas pela mistura de duas cores primárias. As cores secundárias são: verde, roxo e laranja.
O azul misturado com o amarelo origina o verde. O azul misturado com o vermelho origina o roxo, e o vermelho misturado com o amarelo origina o laranja.
25/09/2014
25/09/2014
As Alunas Brunna Fernandes e Ana Maria Chaves apresentaram Experiencias em que entraria na Física: Pressão Atmosférica no Copo Com Água e Cartolina e
A Vela Que Levanta Água.
Pressão Atmosférica no Copo Com Água e Cartolina
Seria possível entornar um copo com água (de cabeça para baixo) sem que ele perca seu conteúdo? Nosso experimento vai mostrar que sim, é possível.
Esta prática pode ser aplicada nos primeiros níveis do ensino fundamental. Ela é segura e simples de ser aplicada. Desde cedo as crianças precisam aprender sobre a força exercida pela atmosfera terrestre.
Seria possível entornar um copo com água (de cabeça para baixo) sem que ele perca seu conteúdo? Nosso experimento vai mostrar que sim, é possível.
Esta prática pode ser aplicada nos primeiros níveis do ensino fundamental. Ela é segura e simples de ser aplicada. Desde cedo as crianças precisam aprender sobre a força exercida pela atmosfera terrestre.
Esta prática pode ser aplicada nos primeiros níveis do ensino fundamental. Ela é segura e simples de ser aplicada. Desde cedo as crianças precisam aprender sobre a força exercida pela atmosfera terrestre.
Material
- 1 recipiente transparente (copo de vidro)
- Água
- 1 folha de papel (do tipo papel cartão)
e... muita agilidade
- 1 recipiente transparente (copo de vidro)
- Água
- 1 folha de papel (do tipo papel cartão)
e... muita agilidade
Procedimento: para que o experimento seja um sucesso, você vai precisar ser ágil.
1. Prepare o copo com um pouco de água (200 ml).
2. Coloque o papel na boca do recipiente e exerça leve pressão para que o papel se fixe (segure por cerca de 1 minuto).
3. Vire o copo e veja o que acontece.
A água não vaza, por quê? A pressão atmosférica se faz atuante.
1. Prepare o copo com um pouco de água (200 ml).
2. Coloque o papel na boca do recipiente e exerça leve pressão para que o papel se fixe (segure por cerca de 1 minuto).
3. Vire o copo e veja o que acontece.
A água não vaza, por quê? A pressão atmosférica se faz atuante.
Explicação
O ar existente ao redor do copo exerce uma força em todos os sentidos, inclusive de baixo para cima. A essa força damos o nome de Pressão atmosférica, ela não deixa que o papel se desloque da boca do recipiente.
A pressão atmosférica exerce essa mesma força sobre a superfície da Terra (força da gravidade) e é por isso que não caímos na imensidão do espaço.
Que tal mostrar essa descoberta para seus alunos? Eles vão pensar que uma força mágica atua sobre o papel!
O ar existente ao redor do copo exerce uma força em todos os sentidos, inclusive de baixo para cima. A essa força damos o nome de Pressão atmosférica, ela não deixa que o papel se desloque da boca do recipiente.
A pressão atmosférica exerce essa mesma força sobre a superfície da Terra (força da gravidade) e é por isso que não caímos na imensidão do espaço.
Que tal mostrar essa descoberta para seus alunos? Eles vão pensar que uma força mágica atua sobre o papel!
A Vela Que Levanta Água
Objetivo
Demonstrar um fenômeno relacionado à diferença de pressão.
Introdução
A explicação desta metodologia é que a combustão da vela consome todo o oxigênio contido no ar. Supondo que a vela seja constituída apenas por pentacosano (na verdade, a vela é uma mistura de vários hidrocarbonetossólidos), a reação de combustão poderia ser representada pela equação:C25 H52 (s) + 38O2 (g) → 25CO2 (g) + 26H2O(g)Como podemos ver pela equação sugerida, os produtos da combustão são gás carbônico e vapord’água. A pressuposição fundamental do método é que o vapor d’água se condensa e o gás carbônico, por ser muito solúvel em água, dissolve-se rapidamente.
Materiais
1 Garrafa 600 ml 1 Copo 100 ml
1 Vela
1 Prato
Água 100 ml
Corante Azul (8 gotas)
1 Colher
Materiais
1 Garrafa 600 ml 1 Copo 100 ml
1 Vela
1 Prato
Água 100 ml
Corante Azul (8 gotas)
1 Colher
Procedimento experimental
Em um prato, fixamos a vela de parafina e completamos o espaço com 100 ml de água e 8 gotas de Corante Azul. A vela é acesa e uma garrafa com a boca para baixo é colocado sobre a vela. Quanto mais transparente for à garrafa, melhor será a visualização.
Resultado e discussões
Acontecerão duas coisas. Primeiro logo em seguida, a vela irá apagar e depois, o nível de água dentro da garrafa irá subir, absorvendo a água ao redor da garrafa. A vela apaga, pois para haver a queima, é necessário um combustor, no caso o Oxigênio, que constitui 20% da atmosfera e se esvai dentro do copo, pois não consegue se renovar.
O nível da água dentro da garrafa sobe, porque, o produto da combustão ocupa menos volume que o oxigênio que havia ali, é como se parte do ar dentro da garrafa fosse compactado, o que diminui a pressão interna, sugando a água ao redor, através das brechas.
25/09/2014
Acontecerão duas coisas. Primeiro logo em seguida, a vela irá apagar e depois, o nível de água dentro da garrafa irá subir, absorvendo a água ao redor da garrafa. A vela apaga, pois para haver a queima, é necessário um combustor, no caso o Oxigênio, que constitui 20% da atmosfera e se esvai dentro do copo, pois não consegue se renovar.
O nível da água dentro da garrafa sobe, porque, o produto da combustão ocupa menos volume que o oxigênio que havia ali, é como se parte do ar dentro da garrafa fosse compactado, o que diminui a pressão interna, sugando a água ao redor, através das brechas.
O nível da água dentro da garrafa sobe, porque, o produto da combustão ocupa menos volume que o oxigênio que havia ali, é como se parte do ar dentro da garrafa fosse compactado, o que diminui a pressão interna, sugando a água ao redor, através das brechas.
25/09/2014
Os alunos Lucas Henrique e Leonardo Simões Apresentaram a Experiencia:
Fritar Ovos Com Álcool
Vamos aprender a fritar os ovos de galinha sem qualquer fonte de calor. Exatamente: sem fogão, fogueira ou fogareiro, apenas substâncias em temperatura ambiente.
Materiais
Ovo;
Frigideira;
Álcool etílico.
Como fazer
Realizar esse processo é uma tarefa muito simples. Tudo o que você precisa fazer é quebrar o ovo e colocar a clara e a gema na frigideira. Depois, despeje o álcool etílico sobre o ovo e veja-o sendo frito bem na frente de seus olhos.
As moléculas do ovo que são as proteínas. Ao jogar o álcool elas se entortam toda, e esse processo se chamam desnaturação, então na hora em que fritamos o ovo ou jogamos álcool sobre ele as proteínas desnaturam e é por isso que ela fica branca.
Como fazer
As moléculas do ovo que são as proteínas. Ao jogar o álcool elas se entortam toda, e esse processo se chamam desnaturação, então na hora em que fritamos o ovo ou jogamos álcool sobre ele as proteínas desnaturam e é por isso que ela fica branca.
Cuidados
Infelizmente, ele não pode ser consumido, porque o álcool etílico pode causar certos “desconfortos intestinais”.
No caso da experiencia apresentada pelos alunos Lucas e Leonardo ovo foi desmembrado ao ser quebrado então fica a dica quebre o ovo com cuidado assim o processo é rápido e eficaz. Olha só com seria caso o ovo fosse quebrado com um pouco de cuidado.
25/09/2014
No caso da experiencia apresentada pelos alunos Lucas e Leonardo ovo foi desmembrado ao ser quebrado então fica a dica quebre o ovo com cuidado assim o processo é rápido e eficaz. Olha só com seria caso o ovo fosse quebrado com um pouco de cuidado.
25/09/2014
Alunas Franciele e Alessandra Moreira Apresentaram a Experiencia:
Densidade do ovo em água
A densidade de uma substância é uma grandeza que relaciona a massa de um material com o volume por ele ocupado. A substância menos densa fica na parte superior quando misturada com substâncias mais densas que ela e vice-versa.
É possível também modificar a densidade de uma substância por misturá-la com outras menos ou mais densas.
Observe como isso é feito e como pode ser realizado em sala de aula, por meio da seguinte experiência simples e com materiais de fácil acesso:
Materiais
1 ovo cru;
1 copo ou béquer (pode ser qualquer recipiente transparente);
Água;
Sal de cozinha (cloreto de sódio – NaCl);
Vareta de vidro ou colher para misturar.
A densidade de uma substância é uma grandeza que relaciona a massa de um material com o volume por ele ocupado. A substância menos densa fica na parte superior quando misturada com substâncias mais densas que ela e vice-versa.
É possível também modificar a densidade de uma substância por misturá-la com outras menos ou mais densas.
Observe como isso é feito e como pode ser realizado em sala de aula, por meio da seguinte experiência simples e com materiais de fácil acesso:
Materiais
1 ovo cru;
1 copo ou béquer (pode ser qualquer recipiente transparente);
Água;
Sal de cozinha (cloreto de sódio – NaCl);
Vareta de vidro ou colher para misturar.
Procedimento
Peça aos alunos que coloquem água até a metade do copo e adicionem o ovo. Eles devem observar quem é mais denso, o ovo ou a água.Em seguida, peça para que eles retirem o ovo, acrescentem sal à água, misturem bem e coloquem o ovo novamente. Que mudança de densidade é possível visualizar?
Resultados e Discussão
Quando se adiciona o ovo cru na água pura, ele vai para o fundo do recipiente, o que nos indica que ele é mais denso que a água.
Porém, quando se adiciona sal na água, o ovo flutua, conforme a figura abaixo:
Isso ocorre porque o sal é mais denso que a água; assim a densidade do conjunto “sal + água”, torna-se maior que a densidade do ovo, por isso ele flutua.
Peça aos alunos que coloquem água até a metade do copo e adicionem o ovo. Eles devem observar quem é mais denso, o ovo ou a água.Em seguida, peça para que eles retirem o ovo, acrescentem sal à água, misturem bem e coloquem o ovo novamente. Que mudança de densidade é possível visualizar?
Resultados e Discussão
Quando se adiciona o ovo cru na água pura, ele vai para o fundo do recipiente, o que nos indica que ele é mais denso que a água.
Porém, quando se adiciona sal na água, o ovo flutua, conforme a figura abaixo:
Isso ocorre porque o sal é mais denso que a água; assim a densidade do conjunto “sal + água”, torna-se maior que a densidade do ovo, por isso ele flutua.
Conclusão
O professor pode complementar a explicação mostrando que a densidade do Mar Morto é tão grande que as pessoas podem flutuar nele, sem se preocupar em afundar. Isso ocorre em razão da alta concentração de sal dissolvido na água desse mar. É inclusive em virtude disso que ele se chama “Mar Morto”; essa concentração de sal impede que haja vida animal e vegetal nesse local.
25/09/2014
25/09/2014
As Alunas Andressa Ismael e Débora Apresentaram a Experiencia:
Ovo Imerso no Vinagre
Colocar um ovo cru no vinagre é uma experiência clássica que ensina o princípio fundamental da química — a interação entre um ácido e uma base. Criar um “ovo emborrachado” é um experimento que demonstra o que acontece quando uma base (a casca do ovo) entra em contato com um ácido (o vinagre).
Material
Efeitos
Submergir um ovo cru inteiro em uma jarra com vinagre e refrigerá-lo por 72 horas produz um “ovo de borracha”, uma vez que o vinagre dissolve a casca que envolve a membrana interna do ovo.
Características
Função
O ácido acético no vinagre quebra os cristais de carbonato de cálcio na casca do ovo em partes separadas de cálcio e carbonato com o subproduto da água. A parte de cálcio se transforma em íons de cálcio no vinagre e água e a de carbonato se transforma em gás de dióxido de carbono que borbulha, sendo expelida enquanto a casca se dissolve.
Significado
Os íons de cálcio são átomos que são partidos em dois elétrons. Esse par se une a dois íons de hidrogênio no ácido acético do vinagre formando dois átomos de hidrogênio que, por sua vez, se unem a um átomo de oxigênio da parte de carbonato do carbonato de cálcio, formando uma molécula de água. Os outros dois átomos de oxigênio da parte de carbonato permanecem unidas ao átomo dessa parte formando uma molécula de gás de dióxido de carbono.
Identificação
As reações químicas ácido-base são caracterizadas pela troca de pares de elétrons entre o doador (a base) e o receptor (o ácido). A reação química demonstrada pelo experimento do “ovo de borracha” é: CaCO³ + 2H+ —> Ca+² + H²O + CO².
Fato curioso
Você também pode fazer “ossos de borracha” colocando ossos de galinha finos de molho no vinagre, uma vez que o carbonato de cálcio também é encontrado em ossos.
26/09/2014
Alunos Jader Mateus e Tallita Vieira
Apresentaram como experiencias cola de caseína: E foi Utilizado Vinagre, Leite e Bicarbonato de Sódio. E também apresentaram o Enchimento De Balão Automático: Bicarbonato de Sódio Utilizando e Vinagre
|
COLA DE CASEÍNA
Preparar cola utilizando leite Como Matéria prima.
DESCRIÇÃO
Análise
A caseína é bastante solúvel em água por se apresentar na forma de um sal de cálcio. Sua solubilidade é fortemente afetada pela adição de ácidos que, pela redução do pH, que reduz a presença de cargas na molécula, que leva a precipitação. Esta redução de pH provoca a perda do cálcio, na forma de fosfato de cálcio, que é eliminado do soro.
Como a caseína se tornou insolúvel em água ao adicionarmos o vinagre, precisamos dissolvê-la para podermos usá-la como cola. Para se tornar a caseína solúvel novamente (pelo menos o suficiente para se obter uma pasta), nós devemos neutralizar o ácido adicionado com bicarbonato de sódio, que é uma base. Observa-se uma liberação de bolhas. Essas bolhas são o resultado da reação do ácido acético contido no vinagre e o bicarbonato de sódio. O gás liberado é o CO2(gás carbônico). A adição de bicarbonato de sódio leva também à formação da caseína de sódio, que tem propriedades adesivas, além de eliminar resíduos de ácido do vinagre. Utilize pequenos pedaços de madeira ou de papel para testar a sua cola. O resultado poderá ser observado em alguns minutos. Divida a cola restante em duas porções e armazene em frascos com tampa. Em um deles, adicione algumas gotas de merthiolate incolor. Feche e agite. Guarde os dois frascos por quinze dias (não coloque em geladeira) e após este período, abra-os e observe. Teste a cola que foi conservada com merthiolate e verifique se ela mantém propriedades adesivas.
Enchimento De Balão Automático
Certamente Que JÁ encheste hum Balão soprando parágrafo Dentro DELE. Mas Nesta Experiência Vamos encher hum Balão SEM soprar. Preciso de: • Vinagre; • Bicarbonato de Sódio (compra-se NAS Farmácias, Supermercados UO los); • Uma Garrafa de Vidro com Gargalo Estreito; • Um Balão Pequeno; • Um funil. Como Fazer: 1. Enche o Balão com Quatro colheres (de CHA) de Bicarbonato de Sódio. EUA O Funil parágrafo ESTA Tarefa Ser Mais Fácil. 2. Enche uma Garrafa com Duas chávenas (de café) de vinagre. 3. Estica a ponta do Balão e coloca-a à Volta do Gargalo da Garrafa. Tem Cuidado Pará Que Localidade: Não Caia Bicarbonato de Sódio Dentro da Garrafa. 4. ENDIREITA o Balão rapidamente, de Modo that o Bicarbonato caia sem vinagre. Observa O Que Acontece. O Que Acontece: When Misturas o Bicarbonato com o vinagre, forma-se a UMA espuma EO Balão COMECA um encher. Isto É Acontece o Porque o Bicarbonato de Sódio EO vinagre reagem hum com o Outro e libertam hum gás. ESSE Gás E o dioxido de Carbono, o MESMO Que FAZ como bolhinhas NAS Bebidas gaseificadas. Experiência Nesta, this Gás E o Responsável POR encher o Balão. When DUAS substâncias colocadas los Conjunto Dão outra substancia Diferente, Diz-se Que HÁ UMA REACÇÃO QUÍMICA. |
25/09/2014






.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)

































.png)



























.png)